以下のプレパラートは、
0.1mol/l の塩酸と
0.1mol/l の水酸化ナトリウムを中和させたものです。
指示薬はBTB液を使っています。

1日冷暗所(気温10℃)で放置し、水分を蒸発させたもの(100倍)
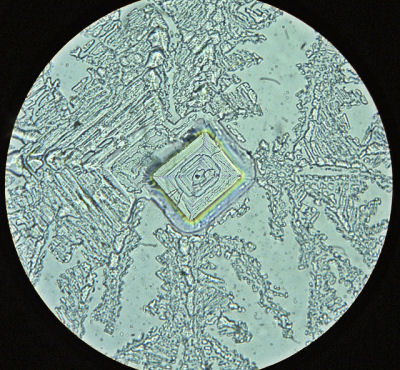
別のプレパラート(200倍)

結晶が点在しているもの(100倍)
この場合なら、「食塩」の結晶であることが、資料集などの写真から考察することができます。
ちょうど、ミョウバンの再結晶の学習の後ですので、スムーズです。
中和反応で本当に塩ができているのか
☆やはりゆっくりやろう
そこで、思い切って2時間扱いでやります。
スライドガラスに1滴のせた後、1日冷暗所で保存します。
ゆっくり水を蒸発させ、溶質の大きな結晶を作ります。
得られた溶質の結晶の形から、溶質の正体を同定します。
☆顕微鏡での観察
以下のプレパラートは、
0.1mol/l の塩酸と
0.1mol/l の水酸化ナトリウムを中和させたものです。
指示薬はBTB液を使っています。

1日冷暗所(気温10℃)で放置し、水分を蒸発させたもの(100倍)

別のプレパラート(200倍)

結晶が点在しているもの(100倍)
この場合なら、「食塩」の結晶であることが、資料集などの写真から考察することができます。
ちょうど、ミョウバンの再結晶の学習の後ですので、スムーズです。
☆その他
顕微鏡の視野が緑がかっているのは、BTBの色です。
ほとんどのプレパラートできれいな結晶がみられますが、
上記写真のように、一部、正方形の結晶の周囲に雪の結晶に似た形が形成されるものや
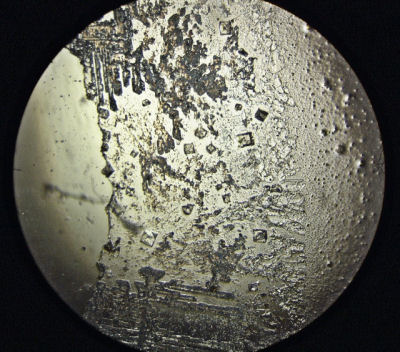
このように、棒状の結晶が多くみられるものがありました。
不純物やpHの違いが影響しているのかもしれません。
考えられる物質としては、NaOHやNaOHが空気中のCO2と反応してできたNa2CO3の結晶です。