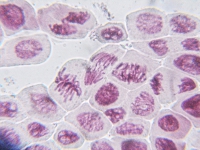
 タマネギの細胞分裂を授業で全員が観察する
タマネギの細胞分裂を授業で全員が観察する
このページのPDF版はこちら
☆教科書に載っているのに難しい実験
この実験は本当に難しい。(と思われています)
染色体の観察ですが、次の点が難しいかもしれません。
(1) タマネギの根がたくさん手に入らない。
(2) 染色された細胞が少ない。
(3) 染色されていても分裂中の細胞がない。
など、いろいろな原因があります。
本当は、分裂像を見ることができる細胞があるのに、観察者が顕微鏡でとらえていないこともあります。
この実験でタマネギがよく使われるのは、ゲノムサイズが非常に大きく(タマネギで約150億塩基対=ヒトの約5倍)にも関わらず
染色体が 2n=16 で16本と多くないので、光学顕微鏡で観察しやすいためです。(参考文献(1))
身近な植物では、タマネギ以外にも、ネギやニラなどが選択肢(染色体数は 2n=16)として選べます。
ただし、ニラは細胞壁が堅くタマネギやネギに比べて、観察時に細胞を押し広げる作業が少し大変になります。
分裂中の細胞を手に入れるため、球根以外に種から発根させたり、染色液に酢酸ダーリアを使用したりという手法(参考文献(2))が紹介されています。
本ウェブサイトでは、酢酸オルセインを使った観察しやすい方法を紹介します。
本観察のワークシートの例です→実験のワークシート(PDF版)
本サイトで、紹介するポイントは次のとおりです。授業で全員が観察できることを目指したいと思います。
1 根のはやし方・・・・「ビーカーにタマネギ」の単なる水栽培では,根がはえにくいようです。
暗所で空気を十分に入れる必要があります。(細胞分裂には,酸素が必要です)
最近の教科書は種から発根させた根を使うようになってきました。
2 採取する時間・・・・タマネギも生き物です。細胞分裂が盛んな時間帯は午前 10:00~10:30ごろがよいようです。
(最近の調査では午後4:00~4:30も盛んであることがわかりました。このページの最初の写真は午後4:00に採取しました。)
3 染色方法・・・・・・せっかく分裂中の根が手に入っても,染色が十分
でなければ光学顕微鏡では観察できません。
酢酸オルセインの場合,塩酸処理する前の根は、最低でも2時間は染色する必要があります。(理想的には72時間)
☆根を手に入れる(1)(種を発根させる)
-
タマネギやネギの種を用意します。(ホームセンターなどで購入。春先はタマネギよりネギの方が入手が容易です。ネギの種類は万能ネギなどがおすすめです)
-
シャーレにティッシュやキッチンペーパーなどの保水材を敷いて種を蒔きます。種がぬれる程度に水道水を与えます。(脱脂綿よりもティッシュなどの紙の方が良好です。脱脂綿は、根がもつれて扱いにくくなります)
-
アルミホイルで遮光します。(保存する場所は、暗室などが適しています。室温25℃前後の時期が最も良好です)
-
根が5mm以上伸びたものを午前10:00~10:30または、午後4:00~4:30に採取します(参考文献(2))。
-
2~3日したらシャーレいっぱいに水道水を入れ、その後水を捨てる作業を行います。(カビが生えるのを防ぎます。値段の安い種はカビが生えやすいようです)



・100円ショップで販売されていたネギの種を蒔いて順に1日目,2日目,3日目(撮影時25℃ AM10:30)
・観察結果からわかったことは、根が実際に伸びる(一つひとつの細胞が大きくなる)のは夜間ですが、
実際に観察した結果から、細胞分裂が盛んなのは、10:00頃と16:00頃です。
・決まった時間に細胞分裂が盛んになるのは、種が遮光されているため、光ではなく、気温が上昇する時間帯の中間と下降する時間帯の中間なのではないかと考えています。
(釣りの世界でも潮汐の上昇と下降の中間前後付近がよく釣れる現象が知られています)
・一方で、時間よりも根の長さ(5mm前後)の方が重要な要素であるという報告もあります。これらの情報をもとに、いろいろ試して見るのが良いと思います。
・種は一度にまくのではなく2~3日ずらして蒔いて毎日適量を採取する方法もあります。
・シャーレごと水槽に入れて、保水剤とシャーレを取り除き、下の写真のように、ザルを通すと能率良く発根した根を回収できます。
・大量に根が必要な場合は、下の写真のようにプラスチックトレーにキッチンペーパーを敷いて、種をまきます。
・ピンセットで、5mm以上になった根を一つひとつ回収していては大変です。
・そこで、トレーに水道水をためてザルなどで一気に回収します。


ザルで回収した様子
☆根を手に入れる(2)(タマネギの鱗茎を使う)
-
タマネギを用意します。(スーパーのタマネギで十分です。 ただし新タマネギではなく、去年収穫された物が良いと言われますが最近の新タマネギは発根します)
-
もともとついている乾燥した根をカッターナイフを使って,水中で切りとります。(空気中で切ると組織の中に空気が入ります)
-
ペットボトルで写真Aのような水栽培用の台をつくります。(ペットボトルを切った後,特大の半田ごてで穴を開けました。)
-
タマネギを3.でつくった台にのせて水槽の中に入れます。水の量は,根がはえる部分が水に少しつかるくらい
とします)
-
金魚用のエアーポンプも入れます。(写真B)(できたら2台入れると良いです。これをやらないから分裂が起きにくくなります)
-
暗い所(暗室など)に置いておきます。(2日くらいで根が伸びるはず。)
-
毎日水を変える必要があります。(カッターナイフで切った次の日は,水が茶色になっている
ので必ず変えてください)
-
5mm以上伸びた根を午前10:00~10:30か午後4:00~4:30にピンセットで採取します(下記参照)



写真A 写真B 写真C
写真A・・・たまねぎの下にペットボトルを切ったものに水が行き交う穴をあけてタマネギを置く台を作る
写真B・・・タマネギをペットボトルの台にのせる。エアポンプで空気を送り,暗室に保存しておく。
写真C・・・設置後24時間後のタマネギ
すでに根が生えています。この中で一番のびている根はすでに「収穫」可能です。
☆根を固定する(「球根の根」と「種の根」との共通処理を行う)
関東地方なら6月前後の気温が25℃付近になる時期を選びます。(寒い時期の実験には温度の管理が必要)
1. 午前10:00~10:30の最も細胞分裂が盛んな時間帯に採取します。
(6時間後の16:00から16:30の時間も良好です)(観察結果からタマネギの根は,1日2回分裂が盛んになる時間帯があります)
2. 午前10時すぎの根をそのまま保存するためにファーマー液(氷酢酸:エタノール=1:3)につけます。
(ファーマー液は1日たったら新しいものに取り替えてください。使いまわしはしない)
(ファーマー液をカルノア液としている本も見かけますが、本来のカルノア液は(エタノール:氷酢酸:クロロホルム=6:3:1)です。クロロホルムを使わなくてもファーマー液で十分固定できます)
3. ファーマー液に1日つけたら,ファーマー液から取り出して、キッチンペーパーなどでファーマー液を良く拭き取り、酢酸オルセインなどの染色液に漬け込みます。(すぐに染色しない場合は、保存のため保存液70%エタノール(水:エタノール=3:7)につけて,冷蔵庫で保存します。(実はこれで半年程度は持ちます)
4. よく染まらない場合は、染色液に72時間つけてから観察して下さい。(タマネギは酢酸カーミンよりも酢酸オルセインがコントラストが良く良好です)
☆観察する
以下の手順を含んだワークシート(PDF版)
-
50mLのビーカーに3%塩酸20mLと,タマネギの根を入れます。(細胞同士をはなれやすくするため)
-
100mLのビーカーに60℃ぐらいのお湯30mL入れたところに、塩酸を入れたビーカーをつけて温めます。
-
2~3分のち,ピンセットで取り出して,水をいれた500mLのビーカーでかなり良く洗ってください。(塩酸がせっかくの染色を脱色してしまうことがあります)
-
スライドガラスにのせ、根の先2mmくらいを残して,先端以外を捨てます。(色の濃い方が先端)
-
カバーガラスをかけ、カバーガラスの上からつまようじの先で円を描くよう
つぶします。
-
低倍率で正方形に近い小さい細胞(分裂したての細胞)が集まっているところをさがし その後、高倍率にします。
◎いくつかの参考書には60℃の塩酸につけた後、染色する手順になっていますが、
長時間染色する場合、塩酸処理した根はどろどろになってしまいやすいので
上記の順序としました。染色した根は、塩酸につけすぎると脱色されますので、
短時間ですませると良いと思います。
◎細胞を広げて観察する重要性
塩酸で細胞同士をはなれやすくし、細胞の重なりがないように広げることが大切です。
プレパラートの様子と100倍で顕微鏡観察した様子を比較します。
下の写真を含むプリント(PDF版)
カバーガラスをかけただけの状態

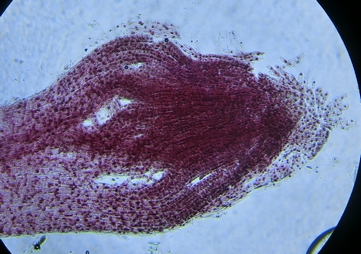
つまようじで1回だけ押した状態

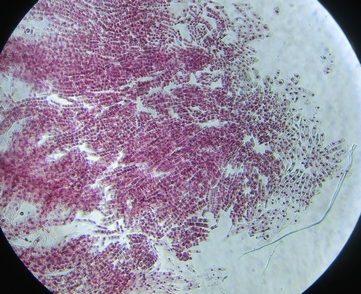
根の周辺をつまようじで3回、円を描くように押した状態

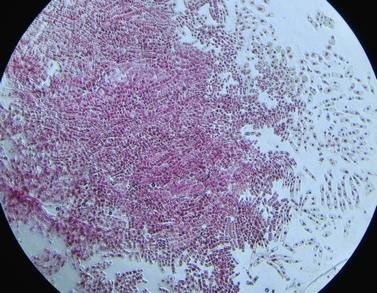
根の周辺をつまようじで5回、円を描くように押した状態

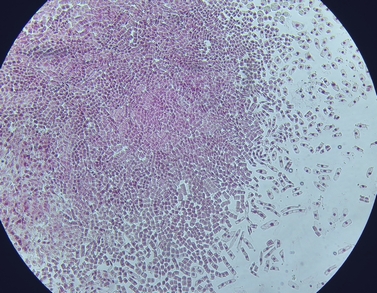
根の周辺をつまようじで変化がなくなるまで円を描くように押した状態

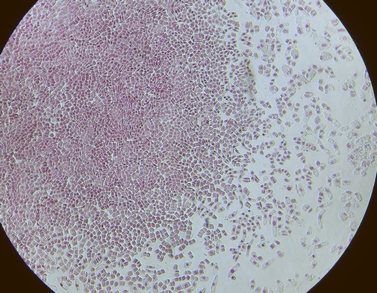
きちんと細胞を広げておくと、100倍の段階でも細胞が重なっているかどうかがわかります。
広げる前の段階から、根の先端には、良く染色された場所(染色体が多い部分)が多いことがわかります。
この部分は細胞の核の数が多いわけですから、細胞の数が多くなります。(分裂直後の細胞が多い可能性がある部分です)
☆観察結果
いろいろな染色液や染色時間の違いによる結果写真です。同じ根を使っても、染色液が違えば、見える分裂像は全く違います。
◎酢酸オルセイン
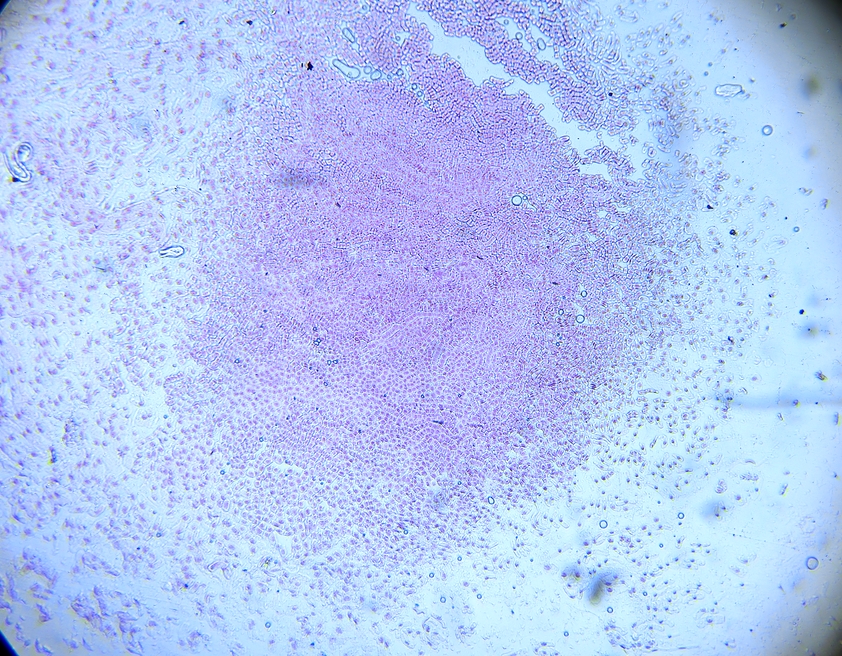
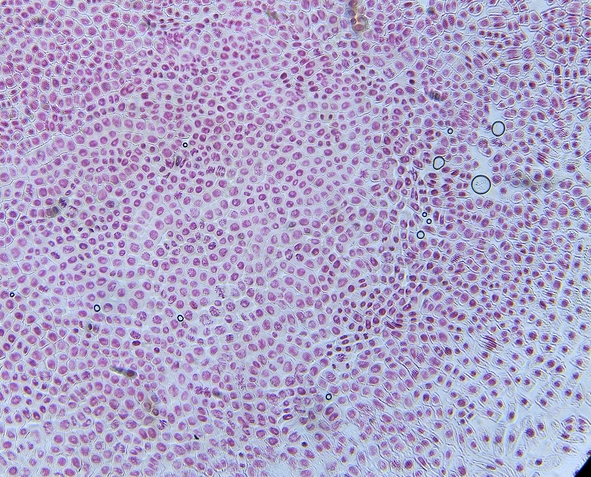
同一プレパラートの同一視野で40倍・100倍・400倍の写真 (96時間染色後、3%塩酸で処理)
下の3枚を含むプリント(PDF版)
40倍
100倍
400倍
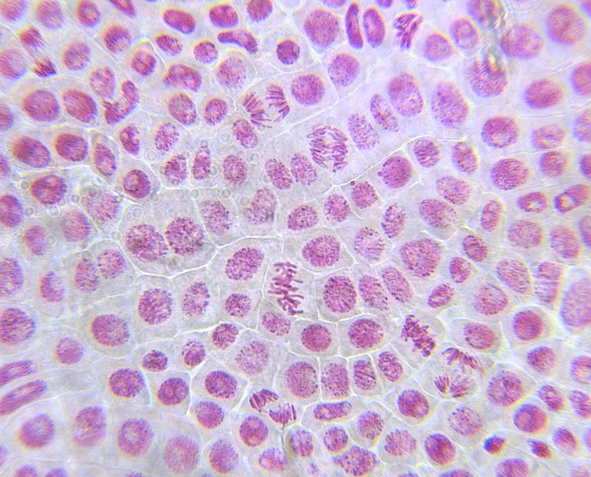
そのほかの酢酸オルセイン
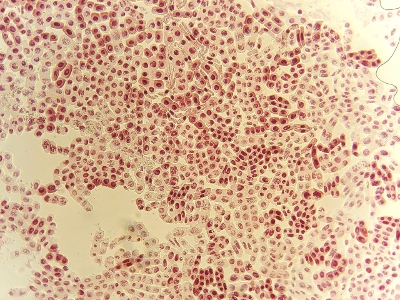
種の根(酢酸オルセイン)(100倍)(塩酸処理前 18時間染色)
低倍率の段階でどの細胞を拡大するか当たりを付けると能率よく観察できます。
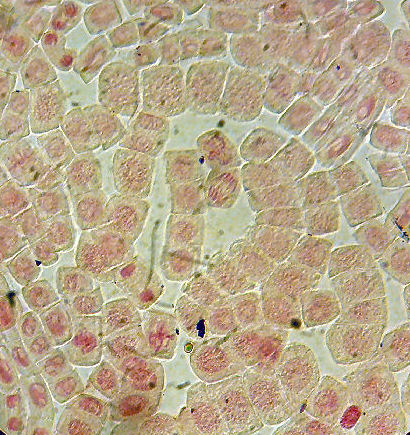
球根の根(酢酸オルセイン)(280倍)(塩酸処理後 5分間染色)
5分間では,染色が十分ではありません。(株)中村理科のデジカメ撮影キットで撮影
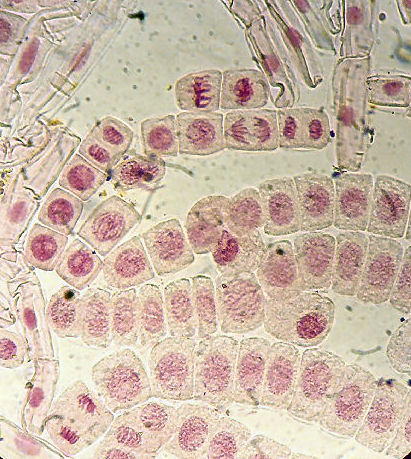
球根の根(酢酸オルセイン) (280倍)(塩酸処理前24時間染色)
(株)中村理科のデジカメ撮影キットで撮影
視野の中に各段階の分裂像がそろっています。
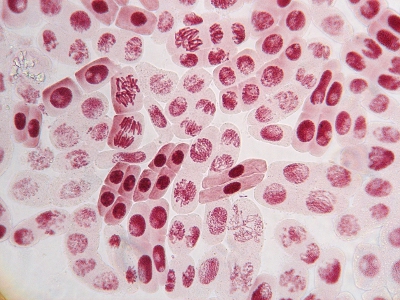
種の根(酢酸オルセイン)(400倍)(塩酸処理前 18時間染色)
サイバーショット(コリメート法で撮影)
視野の中に各段階の分裂像がそろっています
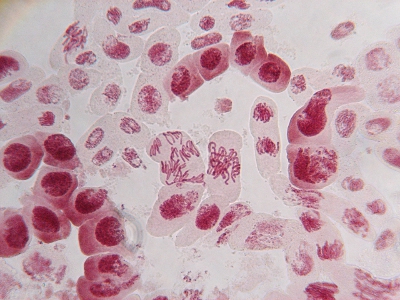
種の根(酢酸オルセイン)(400倍)(塩酸処理前 18時間染色)
サイバーショット(コリメート法で撮影)
酢酸オルセインの染色はコントラストがよいので染色体がこのように
鮮明に見える細胞も観察できます。
◎酢酸カーミン
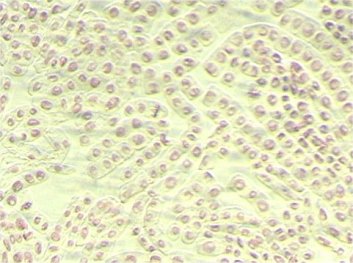
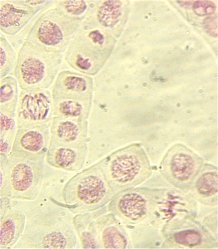
球根の根(酢酸カーミン15分染色)(70倍) (400倍)
(株)中村理科のデジカメ撮影キットで撮影
酢酸カーミンは酢酸オルセインよりもコントラストが悪く
なります。
◎酢酸インジゴカーミン
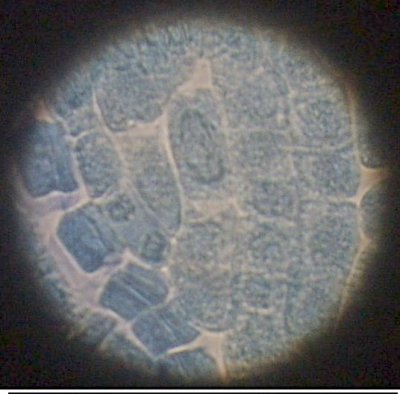
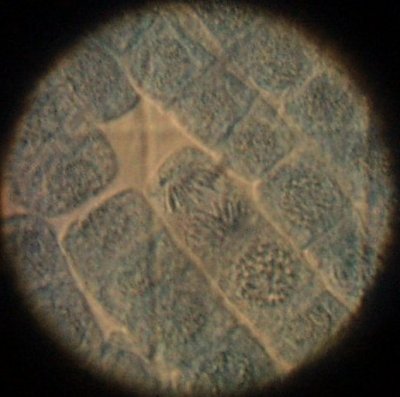
球根の根(塩酸処理後 酢酸インディゴカーミン)(600倍)
オリンパスC-1000Lで撮影
◎酢酸ダーリア
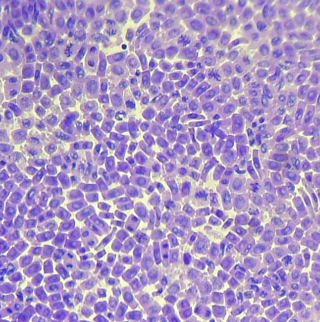
種から発根したもの(酢酸ダーリア24時間染色後3%塩酸で2分脱色)(150倍)
File Pixで撮影
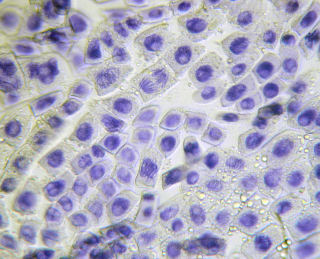
種から発根したもの(酢酸ダーリアと塩酸の混合液で10分染色)(150倍)
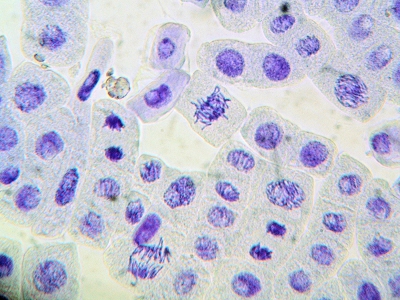
種から発根したもの(酢酸ダーリアと塩酸の混合液で10分染色)(400倍)
☆染色液について
本観察ではきちんとした根が手に入っても染色で失敗することが多いようです。
(1) 染色が足りず、分裂中の染色体が染まっていない
(2) 染色しすぎて、細胞質まで染まり、染色体がはっきり見えない
それぞれの染色液の染色条件や染色時間により、上記(1)(2)のどちらかの失敗をしてしまうことがあります。
◎酢酸カーミン
・アセトカルミンなどの名前の市販品を使用します。染色力は弱いのですが核だけがきちんと染まります。
・しかし15分以上染色する必要があります。
・薬品庫においてある古いものは染色力が弱いのでこの実験には使わない方がよいかもしれません。
・タマネギの皮の観察では酢酸オルセインよりも早く染まり十分使えます
◎酢酸オルセイン(この実験ではおすすめ)
・調整済みの市販品もありますが高価です。本実験では、オルセインという色素を購入し,オルセイン0.5g+45%酢酸100mLで調整しました。
・酢酸カーミンより深い赤色に染色されます。カーミンよりコントラストが良く、塩酸に対しての「抵抗力?」が高いので、、染まりが良好です。
・オルセインは染色に時間がかかる傾向があります。反面、1週間くらいつけ込んでも細胞質はそれほど染まっていません。
・染色体と細胞質のコントラストがよく、目を凝らさなくてもしっかり観察できます。
◎酢酸ダーリア
・ダーリアバイオレットという色素を購入し,ダーリア0.5g+30%酢酸100mLで調整。紫色~青色に染色されます。
・注意点は、酢酸ダーリアは細胞質まで強く染色されてしまいます。
・塩酸と混合し乖離も同時に行う手法が報告されています。(参考文献1)
・本実験では、酢酸ダーリア液と1N塩酸とを7:3混合した液で10分染色するのが一番良い結果を得ました。
・長時間染色すると細胞質が染まりすぎて観察しづらくなります。
・なお、酢酸ダーリアで染まりすぎた根は、塩酸につけることによって少し脱色されます。3%塩酸25℃で5分つけるとほぼ脱色されてしまいます。
・脱色については、2分くらいが一番良い結果を得ました。
◎酢酸インディゴカーミン
・インディゴカーミンという酸素の検出などで使われる色素を使います。インディゴカーミン0.5g+45%酢酸100mLで調整します。
・インディゴカーミンは他の色素より安価ですので、大量に使用したい場合はおすすめです。しかし、細胞質まで染まり、観察しづらいのが難点です。
・褐色瓶に保存しても1年で変色し使用不可になります。毎回使うときに新しく作る必要があります。
☆その他
・種から発芽した根を使う方法が手間がかかりません。しかし、球根の根よりも細いので細胞の数が少ないという欠点があります。
・ニラの種も細胞分裂の実験に使えます。しかし、細胞の形がいびつなものが多く、栽培時に猛烈なにおいを発するのであまりおすすめできません。
・ネギの種もいろいろな種類がありますが、「万能ネギ」が手に入りやすく、発根が早いようです。太いネギの品種は高価で、根が太く使いやすいですが、万能ネギより発根速度が1日程度遅いようです。
・カルノア液は本来(エタノール:氷酢酸:クロロホルム=6:3:1)をさしますが、エタノール酢酸(エタノール:氷酢酸=3:1)とすることがふえているようです。エタノール酢酸は「ファーマー液」とも呼んで区別していることがあります。ファーマー液やカルノア液に長時間つけていると、細胞質の中に気泡が入り、観察しにくくなります)
・実験で準備した発根した根は、70%エタノール水溶液につけて冷蔵庫で保存しておけば1年弱は持ちますが、観察すると細胞膜が壊れているものや細胞質が濁り観察しづらくなっている細胞が増えています。できれば、毎年新しい根を準備するのが望ましいようです。
・顕微鏡写真は,デジタルカメラを直接接眼レンズに近づけて撮影しました。なかなかピントがあいませんが,接眼レンズから5mmカメラを離すだけで,ピントがあいやすくなりました。(酢酸カーミン・酢酸オルセインの写真は,(株)中村理科のデジカメ撮影キットを使いました。)
・細胞分裂に酸素が必要であることを知らない人が多いようです。(私も知りませんでした) だからこそビーカーに乗せただけのタマネギがなかなか発根しないわけです。金魚用のエアーポンプをタマネギをのせている水にセットすると、たちまち発根します。
☆参考文献
・(1) 公益社団法人 かずさDNA研究所 https://www.kazusa.or.jp/dna/achievement/result-27/
・(2) 半本秀博,2000年.「体細胞分裂の観察を確実に行う簡易染色法と材料の条件」.遺伝,54:50-54.
←戻る
トップ
 タマネギの細胞分裂を授業で全員が観察する
タマネギの細胞分裂を授業で全員が観察する





























